
您当前的位置: > 科普知识 >
- 全网发布:10-27 11:01 发表者:fuda_xxfb
徐克成大讲堂 | 肿瘤微环境(TME)的演变——从癌症发生到转移性生长
肿瘤微环境(TME)包括多种免疫细胞类型、癌相关成纤维细胞、内皮细胞、周细胞和各种其他组织细胞类型。这些宿主细胞曾被认为是肿瘤发生的旁观者,但现在已知在癌症的发病机制中发挥关键作用。日前,广州复大肿瘤医院医疗四科副主任行艳丽在“复大新视野徐克成大讲堂”第27讲上,与大家分享肿瘤微环境的演变。

1.何为肿瘤微环境(TME)?
“肿瘤微环境”这一概念最早是在1979年由Lord提出的。这个学说形象地将肿瘤细胞喻为“种子”,将其他维持肿瘤细胞生长的成分叫做“土壤”,也被称为“种子与土壤”学说。
在“肿瘤微环境”中,除了作为“种子”的肿瘤细胞,还有构成“土壤”的基质细胞(包括免疫细胞、成纤维细胞、炎性细胞、胶质细胞、脂肪细胞、平滑肌细胞等)和细胞外基质。它们共同构成的局部稳态环境构成了肿瘤发生、发展、侵袭、转移的必要物质基础。肿瘤细胞这颗“种子”就是借助于肿瘤微环境这样一块肥沃的土壤,逐步生根发芽、茁壮成长的。
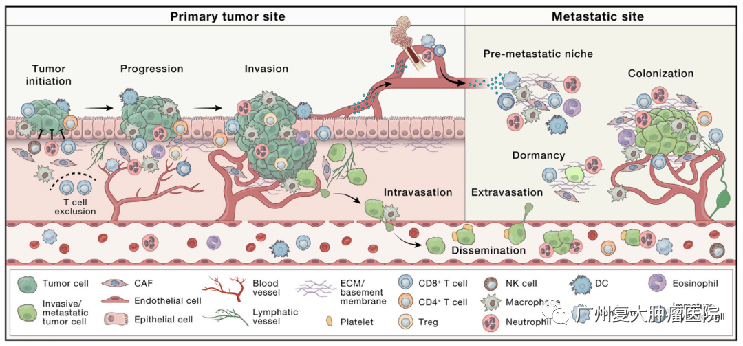
TME是一个高度结构化的生态系统,其细胞组成和功能状态可能会因肿瘤发生的器官、癌症细胞的固有特征、肿瘤分期和患者特征而大不相同。这些细胞可以是肿瘤抑制性的,也可以是肿瘤支持性的。
早期的肿瘤微环境往往是遏制肿瘤发展的,但是肿瘤通过微环境的相互作用包括征用或劫持生理信号通路等多种机制,或正向或负向调节肿瘤的生存、增殖和进展,到了后来,晚期肿瘤的微环境则具有促恶性作用的。
同时,当肿瘤细胞要侵入到一个新的组织和器官的时候,需要和该器官的微环境进行“谈判”,有的微环境容易被说服,肿瘤就会轻而易举的扩散到该器官上,但是有的微环境就直接开打,癌细胞就被消灭无法形成转移。
2.肿瘤起始:组织稳态的破坏
恶性细胞必须克服多个节点才能成功形成肿瘤。如打破免疫平衡、炎症的催化、肿瘤相关成纤维细胞(CAFs)和细胞外基质的重塑、血管生成等等。
3.肿瘤进展:癌细胞的侵袭和迁移、血管内渗
一旦肿瘤成功地在血管生成、炎症和纤维化之间建立了相互加强的联系,它们就可以进入疾病进展的下一阶段:局部侵袭。侵袭性生长是癌症的主要特征之一,为转移性传播奠定了基础。
侵袭是一个复杂的多步骤过程,为了与邻近的癌细胞分离,必须破坏上皮细胞与细胞之间的粘附。细胞间粘附蛋白(E-钙粘蛋白)的缺失是这一过程的核心,通常伴有上皮-间充质(EMT)样的过渡状态。来自TME的因素促进了癌症细胞的表型转换,导致局部侵袭。
此外,越来越多的证据表明,CAF通过其重塑和施加物理拉力在ECM中生成轨迹,从而实现癌症细胞的集体侵袭。研究发现,其他TME细胞,如CAF、免疫细胞和组织驻留细胞共同促进了癌细胞的侵袭行为。
转移过程中的下一个限速步骤是将癌症细胞注入血液或淋巴循环。癌症细胞跨内皮层进入循环的机制复杂、依赖于环境,并受癌症细胞固有特征、ECM的特性和血管系统类型、微环境因素以及缺氧程度的影响。
4.肿瘤转移:转移前生态位的形成
发展中的肿瘤对宿主的影响并不局限于局部TME。通过旁分泌效应,原发肿瘤触发一连串事件,在远处器官中产生癌症细胞传导微环境,然后发生转移扩散。
原发肿瘤通过为未来弥散性癌细胞的到来做准备,远远超出其边界,称为转移前生态位,这一认识导致了我们对转移理解的转变。
触发导致转移前生态位相生成的一系列系统变化的起始信号包括肿瘤衍生的可溶性介体,最显著的是G-CSF、VEGF-a、PLGF、TGF-β,TNF以及携带肿瘤信息的EVs。这些肿瘤信息可以转移到骨髓细胞和远处器官中的驻留细胞,在那里,它们激活并编程免疫细胞及其祖细胞,以动员到未来的转移部位。此外,其他肿瘤分泌的介质可以直接修饰远处的器官。
原发性肿瘤促进转移生态位的另一个机制是通过肿瘤诱导的全身炎症和免疫抑制,有利于播散性癌症细胞的免疫逃逸。
5.循环肿瘤细胞(CTC)的生存之战
一旦肿瘤细胞侵入循环,它们就会在这种外来微环境中立即受到一系列不同的生存挑战,包括由细胞脱离引起的失巢,血液循环中的高剪切力以及免疫介导的攻击,这些共同导致大多数CTC的死亡。
尽管如此,对于通过循环存活下来的一小部分CTC来说,它们可以通过各种机制逃避破坏。其中包括:
CTC聚集,其通过诱导NANOG、SOX2和OCT来促进干细胞性;
与特定的免疫细胞如中性粒细胞或血小板的结合,从而逃避包括NK细胞在内的细胞毒性免疫细胞的作用。
与这些机制一致,CTC聚集与单个CTC相比,通常与更差的患者预后有关;而循环中中性粒细胞与淋巴细胞的高比率与多种癌症的不良预后相关。
对于通过循环存活的一小部分CTC,其转移过程中的下一个限速步骤是外渗到转移器官。这在一定程度上取决于每种原发性癌症的潜在器官趋向性。
这种器官趋向性受到多种机制的影响,包括趋化因子、代谢物和EV等因素的信号传递,这些因素有助于CTC定向迁移到特定器官。
此外,CTC所走的特定循环路线以及癌症细胞为了进入特定器官而必须跨越的不同血管屏障的范围进一步影响了它们的最终目的地。
对于外渗过程本身,肿瘤细胞必须首先停止并附着在内皮管腔上,同时不断受到周围快速流动的血液的高剪切力。
肿瘤细胞和内皮细胞表达的细胞粘附分子及其配体、整合素和ECM成分促进了这一步骤,并与血液白细胞滚动、粘附和外渗的分子机制有一些相似之处。渗出后,CTC通常留在血管附近,这对其命运至关重要。
此外,CTC还可以通过非蛋白水解机制进行渗出,如透析。这种外渗模式在CTC从淋巴管进入淋巴结时也更为典型。虽然淋巴传播、神经周迁移和胸膜腔或其他体腔的生长在一些癌症中有报道,但这些CTC传播的其他路径远不如血行传播频繁。
6.肿瘤的休眠和生长
播散性肿瘤细胞(DTC)在外渗到继发部位后,面临着来自外来组织环境的一系列新挑战,并且绝大多数肿瘤细胞再次被宿主防御机制杀死,包括免疫监测。少数存活下来以培育新器官的DTC通常留在脉管系统附近。
来自血管周围生态位(PVN)的分子信号以及组织特异性生态位,如骨的内膜生态位,最初似乎使DTC处于休眠状态,这可能会保护它们免被免疫系统的识别和杀死。
休眠是转移级联反应中最不为人所知的阶段,部分原因是研究这些罕见细胞的固有挑战。这些细胞会停止增殖,并可以在静止状态下存活,有时长达数年至数十年。对控制休眠开始的机制、休眠在潜伏期的维持以及休眠后的重新激活的研究,仍然是癌症领域的“黑匣子”。
最近的研究开始揭示对控制休眠开始的机制、休眠在潜伏期的维持以及休眠后的重新激活的研究,尤其是与微环境的关键相互作用,以实现器官特异性转移的精细调节。
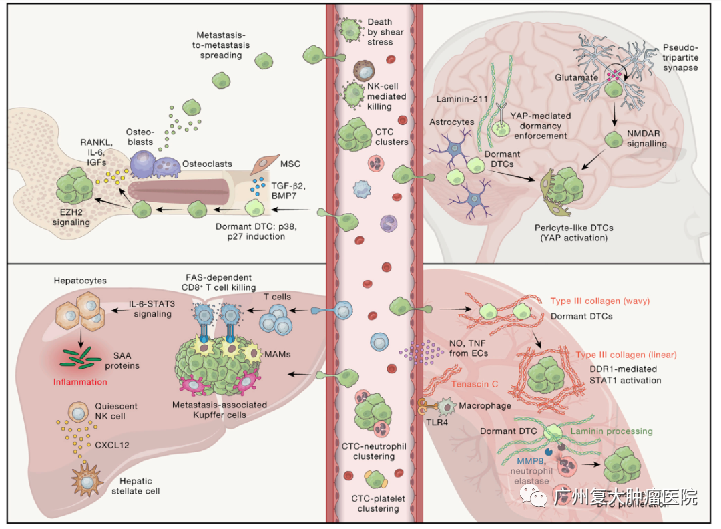
随着近年来在肿瘤微环境范围和理解上的发展,我们逐渐意识到TME的巨大复杂性和相互关联性,以及它在不同器官和患者之间的多样性。尽管存在这些挑战,但在针对TME的治疗策略也在不断扩展,展现出有希望的前景。其中包括通过改变ECM、EVs的干预措施“重编程”TME的治疗、细胞疗法和疫苗以及免疫检查点抑制剂。而现在的关键问题是如何以合理和最佳的方式将这些不同的方法结合起来。随着医学的技术不断突破,相信在不久的将来,靶向TME能够造福更多的癌症患者。
相关热门词:

































 粤公网安备 44010602001792号
粤公网安备 44010602001792号